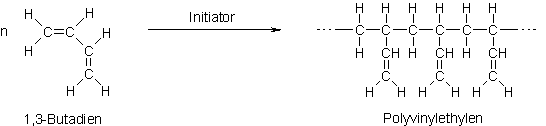
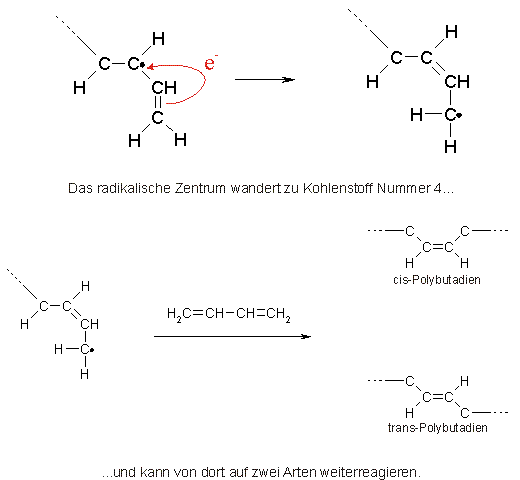
Kunststoff Lexikon |
|
Partner-Websites: Kunststoff-Guide Kunststoff- Deutschland Industrie-Schweiz Schweizer-Verpackung |
Kunststoff-Schweiz - das Internetportal für
die Schweizer Kunststoff-Industrie
☰Menü
|
|
|
|