Kunststoff Lexikon |
|
Radikalische Polymerisation |
|||||||||
|
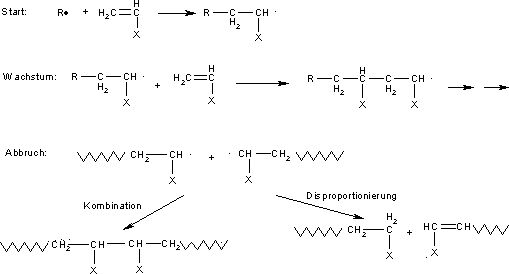
Die radikalische Polymerisation umfasst im Wesentlichen drei Teilschritte: 1. Startreaktion, bei der das aktive Zentrum gebildet wird. 2. Wachstumsreaktion, bei der die makromolekulare Kette in einer Kettenreaktion wächst (wiederholte Anlagerung der Monomere) und 3. Abbruchreaktion, bei der das Wachstum der Kette durch Disproportionierungsreaktionen oder Kombinierung irreversibel beendet wird.
Kinetik der radikalischen Polymerisation Für jede der Teilreaktionen der radikalischen Polymerisation lassen sich Gleichungen für die Reaktionsgeschwindigkeiten formulieren. Die Kenntnis dieser Zusammenhänge ermöglicht es, den mittleren Polymerisationsgrad eines entstehenden Polymers zu steuern, sowie einige bei der Polymerisation auftretende Effekte zu deuten.
Es entstehen zunehmend Initiator-Radikale, Primärradikale und wenige oligomere Radikale. Die Gesamtreaktionsgeschwindigkeit steigt rasant, der durchschnittliche Polymerisationsgrad ist gering.
Bei so geringem Umsatz kann die Monomerkonzentration als konstant betrachtet werden, ebenso die Anzahl vorhandener Radikale, die Gesamtreaktionsgeschwindigkeit bleibt konstant, während der Polymerisationsgrad steigt. Es entstehen erste Makroradikale. Die Polymerisationsgradverteilung ist relativ eng.
Die Monomerkonzentration nimmt durch den Verbrauch stark ab, wodurch die Reaktionsgeschwindigkeit abnimmt. Es sind nun viele Makroradikale vorhanden und Abbruch-Reaktionen finden statt.
Die Polymerisation unterliegt einer Selbstbeschleunigung. Es liegen nun sehr große Polymerradikale vor, die wegen ihrer Größe diffusionsgehindert sind. Das hat zur Folge, dass immer weniger Abbruchreaktionen statt finden, während der Initiator weiterhin zerfällt und neue Radikale bildet. In dieser Phase nimmt der Polymerisationsgrad stark zu und die Polymerisationsgradverteilung wird sehr breit.
Die Reaktionsgeschwindigkeit fällt zunehmend bis zum Minimum ab. Die Polymermoleküle und Polymerradikale sind mittlerweile so groß und unbeweglich, dass das Reaktionsgemisch langsam erstarrt (deswegen "Glas"). Es wird nie der thermodynamisch mögliche maximale Umsatz erreicht, da viele Monomere im erstarrten Reaktionsgemisch gefangen bleiben, ohne zu reagieren. |
|||||||||
|
|||||||||
|
Partner-Websites: Kunststoff-Guide Kunststoff- Deutschland Industrie-Schweiz Schweizer-Verpackung |
Kunststoff-Schweiz - das Internetportal für
die Schweizer Kunststoff-Industrie
☰Menü
|
|
|
|