|
Die kationische Polymerisation ist für die Herstellung von Polyisobuten von großer wirtschaftlicher Bedeutung, daher soll sie hier am Beispiel von ebendiesem Kunststoff besprochen werden.
Initiation
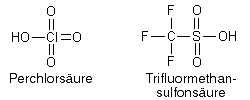
Die Initiation kann durch starke Brönstedt-Säuren geschehen, z.B. durch Perchlorsäure oder Trifluormethansulfonsäure, die leicht Protonen (H+) abspalten, die dann zum Initiator für die Kettenreaktion werden:
Meistens verwendet man jedoch eine raffiniertere Methode, um die ersten Kationen zur Initiation der Reaktion zu erzeugen, nämlich die Initiation durch eine Lewis-Säure wie z.B. Aluminiumchlorid (AlCl3).
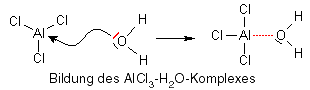
Aluminiumchlorid ist eine sogenannte Elektronenmangelverbindung, d.h. die äußerste Schale des Aluminiumatoms ist nicht mit acht Elektronen besetzt, wie es alle Elemente der zweiten Reihe des Periodensystems anstreben (Oktettregel), sondern nur mit sechs. Es wird daher versuchen, ein weiteres Elektronenpaar aufzunehmen, um die Oktettregel zu erfüllen, aber woher? Glücklicherweise ist fast überall Wasser vorhanden, und Wasser besitzt gleich zwei freie Elektronenpaare, von denen es bereitwillig eins zur Verfügung stellt, wodurch ein AlCl3-H2O-Komplex entsteht.
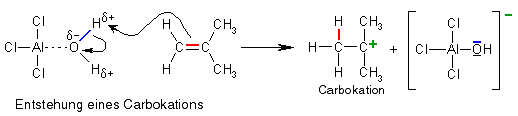
Doch wo ist jetzt ein Kation? Das entsteht im nächsten Schritt: Sauerstoff ist sehr elektronegativ, d.h. in dem AlCl3/H2O-Komplex sind das Sauerstoffatom negativ und die Wasserstoffatome positiv polarisiert, letztere lassen sich daher leicht abspalten, wenn sich eine gute Gelegenheit bietet. Und diese Gelegenheit kommt mit unserem Monomer, Isobuten, das eine elektronenreiche Doppelbindung besitzt (die Pfeile zeigen die Verschiebung von Elektronenpaaren):
Das entstandene Carbokation ist sehr unstabil, weil auch hier, wie beim Aluminiumchlorid, die Oktettregel nicht erfüllt ist: Das Kohlenstoffatom mit der positiven Ladung ist nur von drei Elektronenpaaren umgeben und nicht mit vier und damit von acht Elektronen. Es macht sich daher auf die Suche nach einem weiteren Elektronenpaar und findet es bei einem weiteren Monomer mit Doppelbindung: Die Kettenreaktion hat begonnen.
Propagation
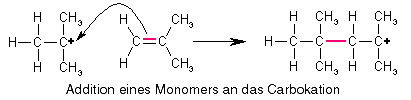
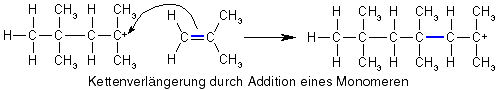
Wie die Propagation, d.h. das Kettenwachstum funktioniert, ist offensichtlich: Bei der Addition des Monomeren an das Carbokation bleibt die positive Ladung erhalten, d.h. das entstandene Molekül ist ebenfalls ein Carbokation, nur ein größeres, und somit kann ein weiteres Monomeres addiert werden und noch eins und noch eins...
Kettenübertragung
Bei der Kettenübertragung hört das Wachstum für eine Kette auf, die Fähigkeit zu wachsen, wird dabei aber auf eine andere Kette oder ein anderes Teilchen übertragen, sodass die Reaktion insgesamt weitergehen kann. Wie sieht das bei der kationischen Polymerisation aus?
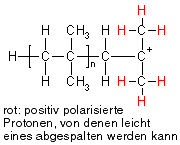
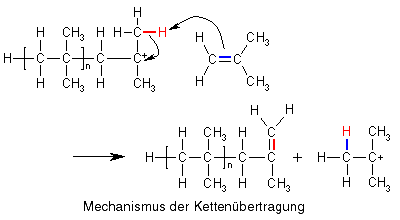
Carbokationen sind, wie bereits gesagt, nicht besonders stabil, weshalb sie leicht mit Monomeren, die eine Doppelbindung besitzen, reagieren (s.o.). Eine andere Möglichkeit, um einen stabileren Zustand zu erreichen, ist für Isobutylkationen die Abspaltung eines Protons (H+), wodurch das Carbokation seine positive Ladung verliert und wieder zum ungeladenen Molekül wird. Abgespalten wird dabei nicht ein beliebiges Proton aus dem Molekül, sondern eines aus den Methylgruppen, die dem Kohlenstoffatom mit der positiven Ladung benachbart ist (eines der in der Zeichnung rot markierten), denn diese sind durch die positive Ladung in ihrer Nähe positiv polarisiert.
Diese Protonen brauchen allerdings einen kleinen Anstoß, um sich vom Molekül zu trennen. Diesen erhalten sie z.B. durch die elektronenreiche Doppelbindung eines Monomeren Isobuten.
Das war ein Mechanismus der Kettenübertragung, bei dem die Reaktionsfähigkeit auf ein Monomeres übertragen gibt, aber es gibt bei der kationischen Polymerisation noch eine andere Möglichkeit der Kettenübertragung: In unserem Reaktionsgemisch gibt es nämlich noch die Anionen, die bei der Initiationsreaktion entstanden sind. Und was passiert zwischen Anionen und (Carbo)kationen? Sie ziehen sich an und können in diesem Fall miteinander reagieren, wobei die Kettenreaktion für das Carbokation beendet wird, dafür aber der AlCl3/H2O-Komplex wiederhergestellt wird, mit dessen Hilfe ein neues Carbokation gebildet werden kann, sodass die Kettenreaktion weitergeht.
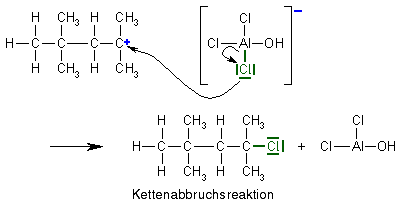
Termination
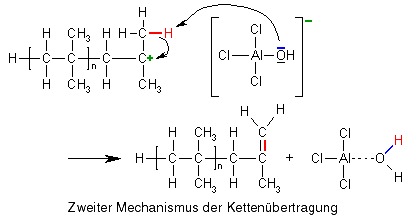
Der Kettenabbruch hat eine Gemeinsamkeit mit der zweiten Möglichkeit der Kettenübertragung: Auch hier reagiert das Carbokation mit dem Anion. Allerdings ist es hier nicht das Sauerstoffatom, das ein Elektronenpaar zur zur Reaktion Verfügung stellt, sondern eines der ebenfalls im Anion vorhandenen Chloratome. Dieses Chloratom reagiert außerdem direkt mit dem Carbokation und nicht mit einem der Wasserstoffatome, sodass am Ende zwei andere Moleküle entstehen als bei der Kettenübertragung, die beide nicht weiterreagieren können. Die Kettenreaktion wird beendet.
|